Radical (chimie) - Radicaux libres
Radical (chimie)
Un radical (souvent appelé radical libre) est une espèce chimique possédant un ou plusieurs électrons non appariés sur sa couche externe. Il se note par un point. La présence d'un électron célibataire confère à ces molécules, la plupart du temps, une grande instabilité (elles ne respectent pas la règle de l'octet), ce qui signifie qu'elles ont la possibilité de réagir avec de nombreux composés dans des processus le plus souvent non spécifiques, et que leur durée de vie en solution est très courte.
Si un radical possède un, deux ou trois électrons célibataires, on le nomme respectivement monoradical, biradical, triradical, etc. La stabilité de ces entités chimiques décroît lorsque le nombre d'électrons célibataires augmente.
Sommaire
[masquer]Génération
Les radicaux sont généralement obtenus par rupture de liaisons chimiques. Étant donné que les liaisons chimiques ont des énergies de l'ordre de centaines de kJ•mol−1, les conditions mises en jeu pour donner des radicaux sont souvent drastiques : hautes températures, radiations ionisantes, ultraviolets.
Une liaison chimique peut se couper de façon homolytique (les deux électrons de la liaison A-B sont répartis équitablement) pour donner deux radicaux :
 •
•  •
•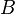 .
.
Si la liaison chimique est rompue de façon hétérolytique (les deux électrons de la liaison sont captés par un des atomes), on a des ions plutôt que des radicaux :
 .
.
L'existence des radicaux libres a été mise en évidence par les chimistes du caoutchouc au début des années 1940.
Un radical libre, possédant un électron célibataire, aura des dérèglements de son champ magnétique, un déséquilibre qui le rendra réactif. Afin de se stabiliser, il va récupérer des électrons sur d'autres molécules, notamment les acides gras polyinsaturés (AGPI), créant ainsi de nouveaux radicaux.
Détection
La présence de radicaux libres dans le corps est caractérisée par une augmentation du système de défense, ou par les dégâts qu'ils ont provoqués.
On peut également mesurer l'activité de deux enzymes : la glutathion peroxydase et la superoxyde dismutase.
Par ailleurs, il y a généralement une corrélation entre les radicaux libres et le vieillissement.
Réactions chimiques radicalaires
En biologie
Le terme « radical libre » est utilisé pour désigner les dérivés réactifs de l'oxygène, ou « espèce réactive oxygénée » (Reactive oxygen species : ROS), ou « radicaux oxygénés libres ». Il s'agit d'une classe spécifique de radicaux.
Exemples et implications toxicologiques
Les dérivés réactifs de l'oxygène :
- l'oxygène singulet •O-O• (ou 1O2) ;
- l'anion radicalaire superoxyde O2•- ;
- le radical hydroxyle HO• ;
- le radical hydroperoxyle HO2 ;
- les radicaux peroxyde (ROO•), radical alkoxyle (RO•) où R est une chaîne carbonée.
Les radicaux dérivant d'un acide gras insaturé.
Le peroxynitrite ONOO•.
Le monoxyde d'azote NO•.
Ces substances peuvent peroxyder les lipides insaturés qui composent les structures membranaires et peuvent alors tuer la cellule. Le remplacement de la cellule oblige l'organisme à activer ses cellules souches, ce qui augmente le risque de cancérisation. Ceci contribue aussi à un vieillissement accéléré de l'organisme, les cellules souches ne pouvant éternellement se multiplier (limite de Hayflick).
En combustion chimique
De très nombreux radicaux sont créés lors de réactions de combustion qui mettent en jeu des températures très élevées (plusieurs centaines voire plusieurs milliers de kelvins).
Cas particulier des carburants dans les réactions de combustion chimique
Dans les réactions de combustion des carburants, de très nombreux radicaux sont générés. Dans le régime de flamme froide, l’isomérisation interne des radicaux peroxyles formés par des réactions impliquant l’arrachement d’atomes d’hydrogène de groupements méthyle n’est pas favorisée. Par exemple dans le cas de C4H9OCH2OO, l’isomérisation interne conduisant à C4H8OCH2OOH, un agent de branchement potentiel, impliquerait un cycle intermédiaire à sept centres.
En deçà de 770 K dans le régime des flammes froides, les mécanismes d’oxydation dominant la réactivité des carburants passent par la formation de radicaux peroxyles pouvant mener à un mécanisme de ramification en chaînes par successivement addition de dioxygène, isomérisation interne et décomposition :
- RH + X (X=H, O, OH, HO2, RO2, etc.) → R + HX (1) ;
- R + O2 → RO2 (2) ;
- RO2 → QOOH (3) ;
- QOOH → QO + OH (4) ;
- QOOH+O2 → OOQOOH (5) ;
- OOQOOH → HOOQ’OOH (6) ;
- HOOQ’OOH → Produits + 2 OH (7).
Exemples en combustion chimique
- L'oxygène singulet •O-O•
- Le radical oxygène •O
- Le radical hydrogène H•
- Le radical hydroxyle HO•
- Le radical hydrurodioxygène HO2•
- Le biradical •NCN•[1]
- Le peroxynitrite ONOO•
- Le monoxyde d'azote NO•
- Le radical cyano •CN
- Le radical méthyle •CH3
Références
- S. Canneaux, A. Wallet, M. Ribaucour et F. Louis, A theoretical study of the NCN (3Σ-) biradical thermochemical properties: Implications for combustion chemistry, Computational and Theoretical Chemistry, 2011, 967 : 67-74
Voir aussi
Bibliographie
- S. Canneaux, A. Wallet, M. Ribaucour et F. Louis, A theoretical study of the NCN (3Σ-) biradical thermochemical properties: Implications for combustion chemistry, Computational and Theoretical Chemistry